پلتفرم آموزشی یاد
اتم ها با به اشتراک گذاشتن الکترونهای لایه ظرفیت خود میتوانند پیوند کووالانسی (اشتراکی) تشکیل دهند و مولکول ها را به وجود بیاورند.
الکترونگاتیوی خاصیتی شیمیایی در اتمهاست که تمایل اتم را به جذب جفت الکترونهای پیوندی به سمت هسته خود نشان میدهد. مثلاً در یک مولکول دو اتمی، یک یا چند پیوند میتواند بین دو اتم وجود داشته باشد. در این مولکول، اتمی که الکترونگاتیوی بیشتری داشته باشد؛ دوست دارد تا الکترونهای موجود در پیوند را به سمت خود بکشد. گاهی به جای واژه الکترونگاتیوی از واژه هایی مثل الکترون دوستی یا الکترون خواهی استفاده میکنند که البته الکترونگاتیوی از این واژهها، مناسب تر است. در مقابل الکترونگاتیوی، «الکتروپوزتیوی» وجود دارد که نشان میدهد، اتم تمایل کمتری به جذب جفت الکترون پیوندی دارد. به عبارتی اتمی که الکترونگاتیوی کمی دارد، الکتروپوزیتو است.
دقت کنید که الکترونگاتیوی و الکتروپوزیتوی برای اتم تنها معنا ندارد و زمانی معنادار میشود که اتم در مولکول مورد بررسی قرار بگیرد.
بیشتر بدانید: سزیم، یک فلز قلیایی با کمترین میزان الکترونگاتیوی (0.79) و فلوئور، یک هالوژن با بیشترین الکترونگاتیوی (3.98) است.
در یک «مولکول» هرچقدر، اتمی الکترونگاتیوتر و در مقابل اتمی الکتروپوزیتوتر باشد؛ آن مولکول قطبی میشود. زیرا یکی از اتمها دوست دارد که الکترون های پیوندی را به سمت خود بکشد پس الکترونها به سمت آن اتم متمایل شده و چون چگالی الکترونی در این بخش مولکول زیاد میشود، قطب منفی ایجاد میکند. از طرفی یکی از اتمها تمایلی ندارد که الکترونهای پیوندی را به سمت خود بکشد بنابراین این بخش مولکول که الکترونها از آن دور میشوند به علت کم شدن چگالی الکترونها در آن ناحیه، قطب مثبت به حساب میآید.
در مولکول هایی که الکترونگاتیوی اتم ها مثل هم دیگر باشد یا اختلاف کمی داشته باشند؛ قطبیت چندان ایجاد نمیشود در نتیجه مولکول را ناقطبی به حساب میآوریم.
نحوه کار با شبیه ساز
برای شروع بر یکی از دو گزینه "دو اتمی" یا "چند اتمی"، کلیک کنید.
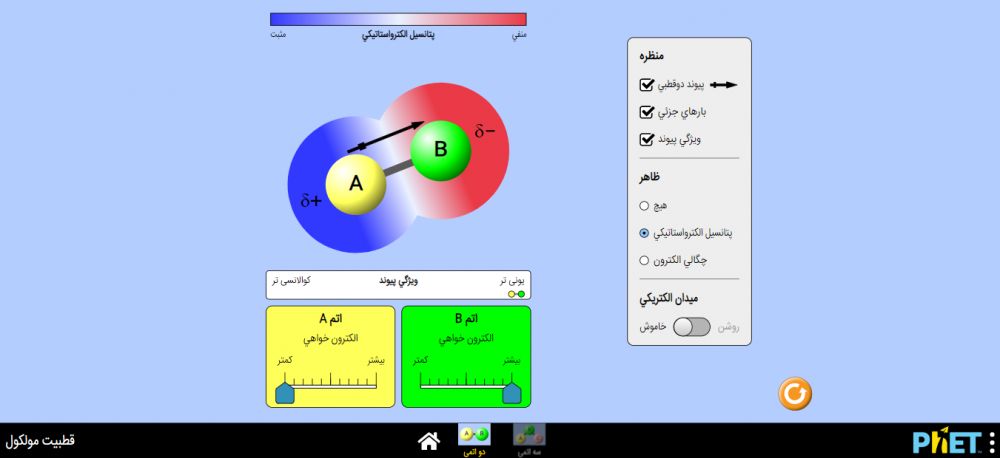
با انتخاب گزینه دو اتمی، یک صفحه جدید برای شما باز می شود. یک مولکول دو اتمی در وسط ثبت مشاهده می کنید که یک اتم A و یک اتم B دارد. بین این دو اتم، یک پیوند برقرار شده است.
در پایین مولکول دو اتمی الکترون خواهی اتم های A و B برای شما نمایش داده است که قابل تنظیم است یعنی می توانید الکترون خواهی اتم را تغییر دهید.
در نوار سمت راست مولکول دو اتمی گزینه هایی مثل: منظره، ظاهر و میدان الکتریکی، برای شما قرار دارد که می توانید آنها را فعال یا غیرفعال کنید.
برای شروع می توانید مانند دستورالعمل زیر پیش بروید:
ابتدا درجه الکترونخواهی را از پایین مولکول AB، تنظیم کنید و الکترون خواهی اتم B را به بیشترین حد خود و الکترون خواهی اتم A را به کمترین حد خود بکشید.
از نوار سمت راست در بخش منظره سه تیک را فعال کنید پیوند دو قطبی بارهای جزئی و ویژگی پیوند را فعال کنید.
با فعال کردن تیک پیوند قطبی از بخش منظره، یک فلش مشکی بر روی مولکول شما ظاهر میشود که از اتم A به سمت اتم B میباشد و این نشان میدهد که الکترونهای موجود در پیوند بین دو اتم، از اتم A دور شده و به اتم B نزدیک میشوند چون اتم B را الکترون خواه تر انتخاب کردهاید.
با فعال کردن تیک بارهای جزئی در بخش منظره، علامت منفی ای که به صورت (دلتای منفی خوانده میشود) در کنار اتم B، به نمایش درمیآید و این نشان می دهد که اتم B الکترونخواهتر (الکترونگاتیوتر) است. درمقابل، علامت مثبت ای که به صورت (دلتای مثبت خوانده میشود) در کنار اتم A، به نمایش درمیآید و این نشان می دهد که اتم A الکترونخواهی کمی دارد یا به عبارتی، الکتروپوزیتو تر است.
به نوار ویژگی پیوند که بالای تنظیم الکترون خواهی است، دقت کنید؛ میبینید که در این حالت پیوند بین A و B در محدوده یونی قرار میگیرد و این نشان میدهد که در یک مولکول، اگر یک اتم الکترونخواهی بسیار زیادی داشته باشد و اتم دیگر الکترونخواهی بسیار کمی داشته باشد آن پیوند خصلت یونی پیدا میکند یعنی پیوند قوی ای میشود.
در بخش ظاهر، تیکهای پتانسیل الکتروستاتیکی یا چگالی الکترون را فعال کنید.
با فعال کردن تیک چگالی الکترونی، ابر الکترونی بر روی مولکول شما ظاهر میشود. هرچقدر ابر الکترونی در ناحیهای پررنگتر باشد یعنی در آن بخش از مولکول چگالی الکترونی بیشتر است یعنی اینکه الکترونهای پیوندی، بیشتر به آن سمت از مولکول متمایل شدهاند.
با فعال کردن تیک پتانسیل الکتروستاتیکی ابر الکترونی بر روی موکول شما ظاهر میشود. بخشی از مولکول که منفیتر باشد، ابر الکترونی در آن بخش قرمزتر و بخشی که مثبتتر باشد ابر الکترونی در آن بخش آبیتر است. یعنی در بخش قرمز، چگالی الکترونی، بیشتر و در بخش آبی، چگالی الکترونی، کمتر است.
با فعال کردن تیک میدان الکتریکی از نوار سمت راست، میدان الکتریکی که دارای دو بخش مثبت و منفی میباشد در اطراف مولکول پدید میآید که شما میتوانید مشاهده کنید که هر بخش مولکول، به کدام سمت میدان جهتگیری میکند. در این شرایطی که با هم انتخاب کردیم، قطب منفی مولکول به سمت قطب مثبت میدان و قطب مثبت مولکول به سمت قطب منفی میدان قرار گرفته است.
حال از نوار مشکی پایین صفحه، مولکول سه اتمی را انتخاب کنید. تمام این مراحل را میتوانید برای مولکول سه اتمی تغییر دهید.
توجه: فقط دقت کنید که در نوار سمت راست مولکول سه اتمی، یک بخش جدید به نام دوقطبی مولکولی ظاهر می شود.
فلش مشکی که مربوط به پیوند دوقطبی است، نشان میدهد که پیوند شما دوقطبی هست یا نه (یعنی در یک پیوند که بین دو اتم است کدام اتم مثبتتر و کدام اتم منفیتر میباشد) اما دوقطبی مولکولی که با فلشی نارنجی نمایش داده شده است، برآیندی از تمام پیوندهای دوقطبی موجود در مولکول است. یعنی این فلش قطبیت کل مولکول را نشان میدهد اما فلش مشکی، قطبیت پیوند بین دو اتم را نشان میدهد.
برای مثال اگر الکترونخواهی هر سه اتم در این مولکول سه اتمی را دقیقاً در وسط بگذارید هیچ فلش نارنجی برای شما نمایش داده نمیشود یعنی این مولکول که هر سه اتم آن، الکترون خواهی مثل هم داشته باشند، مولکول ناقطبی میشود و قطبیت کل ندارد.
حال با تغییر الکترونخواهی اتمها، تمام گزینههای مربوط را مشاهده کنید و قطبیت مولکول را با این شبیه ساز خوب، یاد بگیرید.
سوال اول: در مولکول دو اتمی، اگر الکترون خواهی هر دو اتم، زیاد باشد. جهت گیری مولکول در میدان الکتریکی چگونه خواهد شد؟
سوال دوم: در مولکول سه اتمی، اگر الکترون خواهی دو اتم بالا و یک اتم کم باشد. تحلیل کنید که پیوند دوقطبی و دوقطبی مولکولی چگونه خواهد بود.
رها
۱۵ اسفند ۱۴۰۱علی کرمی
کافی است صبر کنید که دکمه روی شبیه ساز از حالت "در حال بارگذاری" به حالت "برای شروع کلیک کنید" تبدیل شود.
سپس می توانید با کلیک روی شبیه ساز آن را فعال کرده و برای کارکرد بهتر از گزینه "تمام صفحه" استفاده کنید.